- 원자의 결합
- 이온 결합
- 공유 결합
- 금속 결합
- 공유 결합의 비율 구하기
1) 원자의 결합
화학결합은 원자의 최외각에 존재하는 원자가전자(valence electron)의 전이나 공유를 통해 인근 원자들과 결합하는 것을 말합니다.

크게 이온결합 / 공유결합 / 금속결합의 세 가지 방식으로 결합하는데, 결합의 특성만으로 어떤 물질을 판단할 순 없습니다.
하지만 대략적인 경향성을 예측하거나 이해하는데 많은 도움을 주기 때문에 세 결합 방식이 어떻게 다른지 알아봅시다!
2) 이온결합(Ionic bond)
서로 다른 전기음성도를 지닌 원자들이
전자를 교환하여 이온이 되면서 쿨롱 힘으로 서로를 끌어당겨 결합하는 방식입니다.

이온 결합의 대표적인 예로 염화나트륨의 경우에, Na는 전기음성도가 낮고 Cl은 전기음성도가 높습니다.
Na가 원자가전자 하나를 내어놓음으로써 양이온이 되고 Cl은 이 전자를 받아 음이온이 되는것이죠
양이온과 음이온은 서로를 끌어당기고 양이온 옆에 음이온, 그 옆에 다시 양이온 이런식으로 입체적으로 배열되어있는 형태입니다
결국 전체적으로는 중성이 되고 NaCl이라는 조성식과 같이 Na와 Cl이 1:1의 비율로 결합되어 있습니다.
3) 공유결합 (Covalent bond)
공유 결합은 둘 혹은 그 이상의 원자들이 서로 전자를 공유하여 원자 각각의 최외각 껍질에 8개의 전자를 채우면서 결합하는 방식입니다.

대표적인 예로 실리콘은 최외각 껍질에 4개의 전자를 갖고있습니다.
네개의 전자가 하나의 실리콘 원자와 전자를 공유하면서 결합을 하게되고, 이로인해 반발력을 최소화 하는 방향의 결합각이 생기게 되는것이죠
공유결합에 관여하는 전자쌍을 공유전자쌍이라 하고, 관여하지 않는 전자쌍을 비공유전자쌍이라고 합니다.
실리콘은 네개의 전자가 모두 결합에 관여하고 있으므로 비공유전자쌍이 없지만, HCl 의 전자식을 보면 어떤게 공유전자쌍이고 비공유전자쌍인지 확인할 수 있습니다.

또 전자 한 쌍이 결합하는것을 단일결합이라하고, 두 쌍이면 이중 결합, 세 쌍이면 삼중 결합이라 합니다.
4) 금속결합 (Metallic bond)
전기음성도가 작은 금속 원자는,
원자가전자들을 내어놓으면서 전자해(sea of electrons)를 형성하고 스스로는 양이온이 되어 가까운 전자들과의 상호인력에 의해 결합합니다
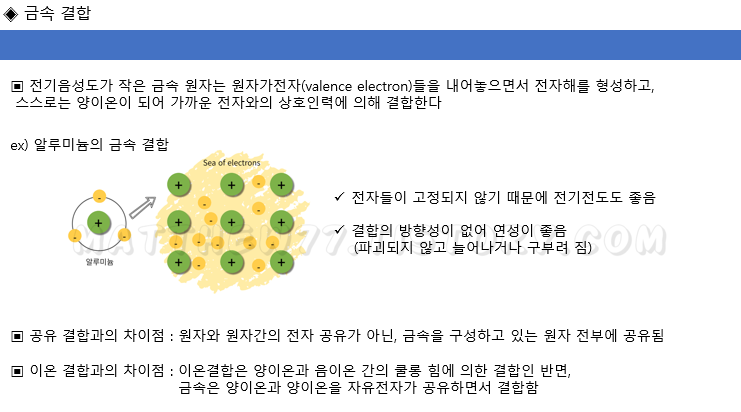
전자들이 고정되어있지 않기 때문에 전기전도도가 높고,
전자들과 양이온간의 결합에 방향성이 없어서 어떤 힘이 가해졌을때 파괴되기보다는 늘어나거나 구부려지게되는 특성이 있습니다.
금속결합은 원자가전자를 내어놓으면서 양이온들이 전자해의 전자를 공유하는 형태이기 때문에
이온결합이나 공유결합과 혼동하지 않도록 주의해야 합니다
5) 공유 결합의 비율 (Fraction Covalent)
SiO2와 같이 실제의 세라믹이나 화합물은 공유 결합과 이온 결합이 혼합되어 있는 형태입니다.
그래서 어떤 결합이 주를 이루는지, 어느정도의 비율로 결합하고 있는지 파악하는 것도 중요합니다

끝!
'반도체 > 재료공학' 카테고리의 다른 글
| Bravais lattice - 고체의 결정구조 (0) | 2024.07.04 |
|---|

댓글